

发表期刊:Advanced Materials
IF:27.4
一作单位:哈尔滨工程大学
研究背景
铜死亡(cuproptosis)是一种可能触发免疫治疗的新型细胞死亡形式,其机制是过量铜离子直接结合线粒体三羧酸循环中的硫辛酰化组分,导致二氢硫辛酸-乙酰转移酶(DLAT)聚集,最终因相关毒性作用引发细胞死亡。但现有的铜基纳米材料无法有效诱导铜离子聚集,铜离子易被转运出细胞,致使铜死亡效率低下。因此,亟需一种能够诱导铜死亡的材料,以逆转免疫抑制性肿瘤微环境并清除肿瘤细胞。
基于铜的半导体铁电材料有望通过铁电效应被细胞吞噬,从而诱发细胞凋亡。通过工程化金属空位,可以调控p型半导体的催化响应,增强表面电荷传输。本研究制备了具有丰富铜空位(VCU)且具有优异压电和铁电特性的纳米材料BCO-VCU,能通过控制蛋白打开细胞膜并关闭Cu+外流通道,从而加剧铜死亡并触发后续的免疫反应。VCU的引入改善了压电特性和铁电剩余极化,相应优化的BCO-VCU也表现出高铁电催化性能和初始极化强度。由此产生的强内置电场为载流子迁移提供了驱动力,高效催化生成活性氧(ROS)诱导细胞死亡。密度泛函理论(DFT)计算揭示了Bi2CuO4(BCO)的半导体类型,VCU是最易形成的空位,这些空位能抑制电子-空穴复合并提高催化效率。这种铁电效应增加了细胞膜通透性,增强Cu²+释放,改变了铁氧还蛋白1(FDX1)和DLAT的表达,并增加了三磷酸腺苷(ATP)释放,这不仅下调了铜离子泵蛋白的表达,从而减少Cu²+外排加剧铜死亡,还增加了高迁移率族蛋白B1(HMGB1)的释放,触发免疫原性细胞死亡(ICD)并刺激后续免疫反应,进而诱导树突状细胞(DCs)成熟及巨噬细胞极化为M1表型,促进杀伤性T细胞分化、免疫微环境重塑及长期免疫记忆的建立。

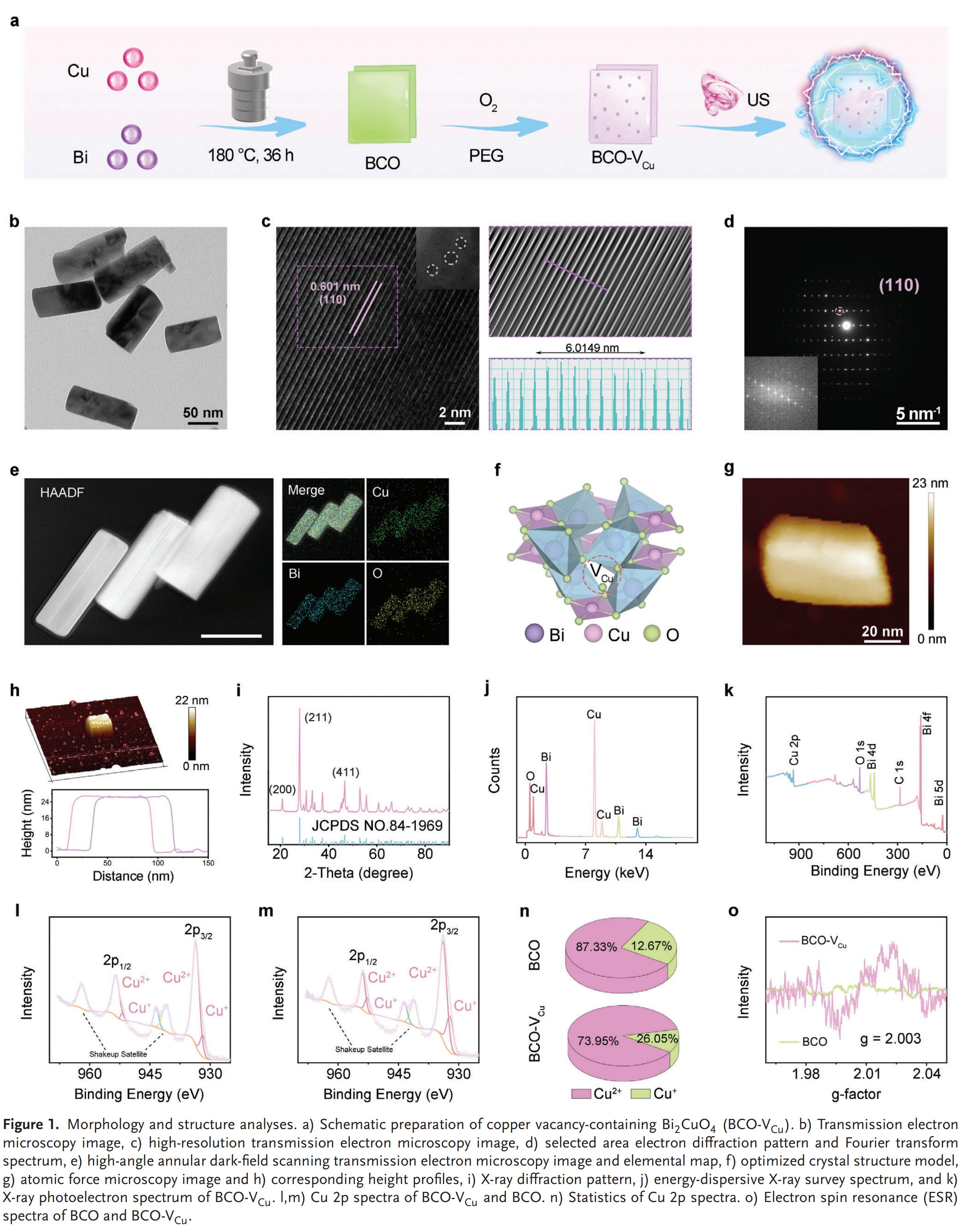
1.形态学与结构
BCO-VCU纳米颗粒是通过水热法制备BCO纳米颗粒后,经O2退火并接枝聚乙二醇(PEG)以增强生物相容性而获得的。BCO-VCU纳米颗粒呈现约120nm×40nm的矩形形貌,该尺寸范围与增强渗透性和滞留效应相兼容,对于BCO-VCU纳米颗粒的有效摄取及其向肿瘤的渗透至关重要。该纳米颗粒具有四方晶体结构,表面存在VCU缺陷,表征证实元素分布均匀,且O2退火显著提升了Cu²+含量。
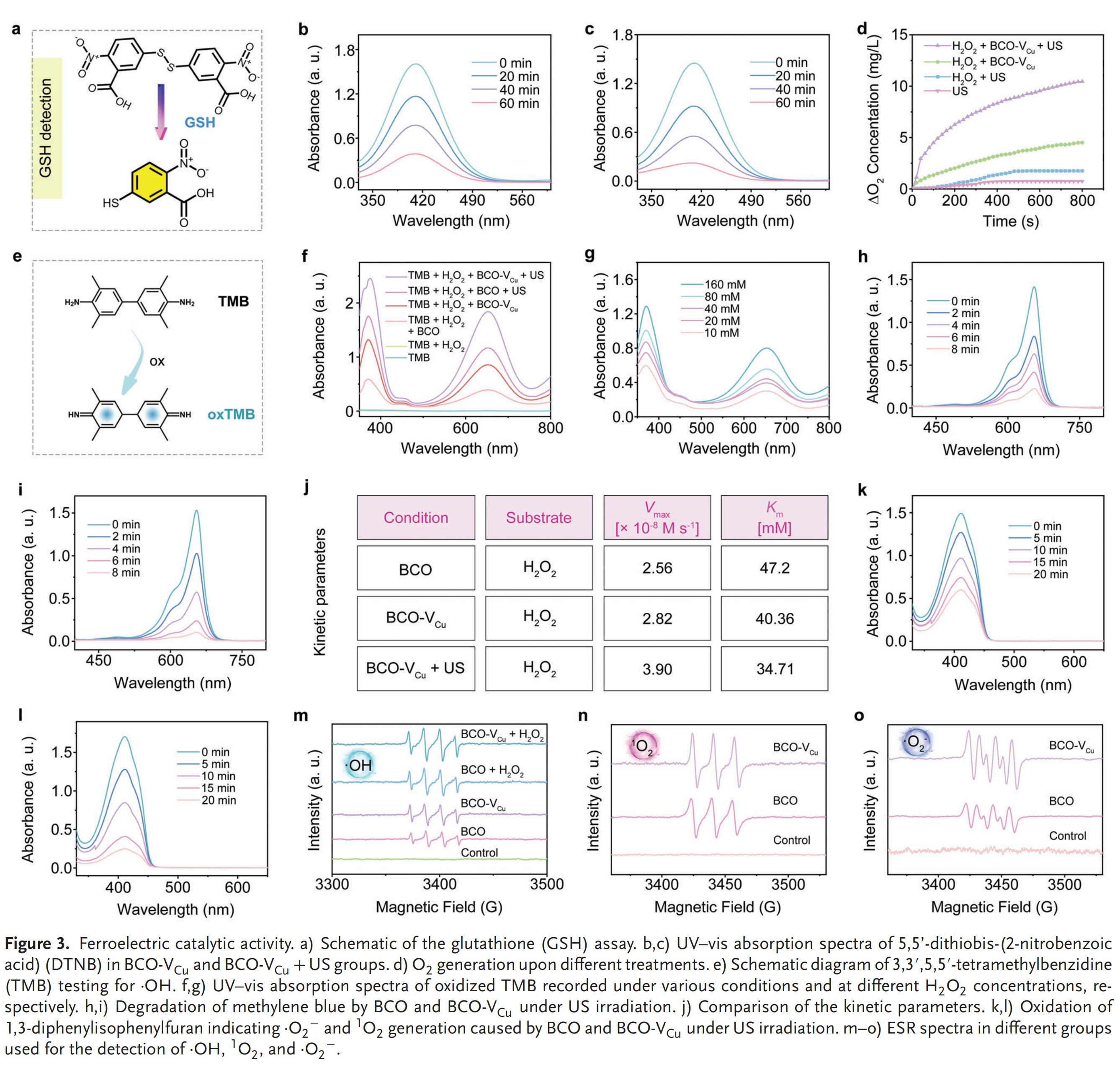
2.铁电材料催化活性的体外评价
BCO-VCU带隙较BCO更窄,且其平带电位更低,表明VCU的引入调整了能带结构。VCU还增强了BCO的压电性能和铁电极化强度,有利于电荷的分离和转移,能产生更高的催化活性。在催化过程中,超声波(US)的机械搅拌为电子激发提供了充足能量,可直接激发电子从价带(VB)到导带(CB),产生的空穴留在VB内部,载流子根据能带水平引发氧化还原反应。

谷胱甘肽(GSH)是一种内源性抗氧化剂,BCO-VCU+US能有效耗竭GSH并产生氧气,破坏细胞氧化还原稳态并缓解肿瘤缺氧微环境。VCU增加了可用于催化的活性位点数量,并抑制了电子-空穴复合,进一步提高了催化效果。同时,其铁电催化作用可高效生成·OH、·O₂−和¹O₂等多种ROS,这同样归因于VCU促进电荷分离,从而促进了电子向O₂的转移和空穴向H₂O的转移,进而促进了ROS的生成。
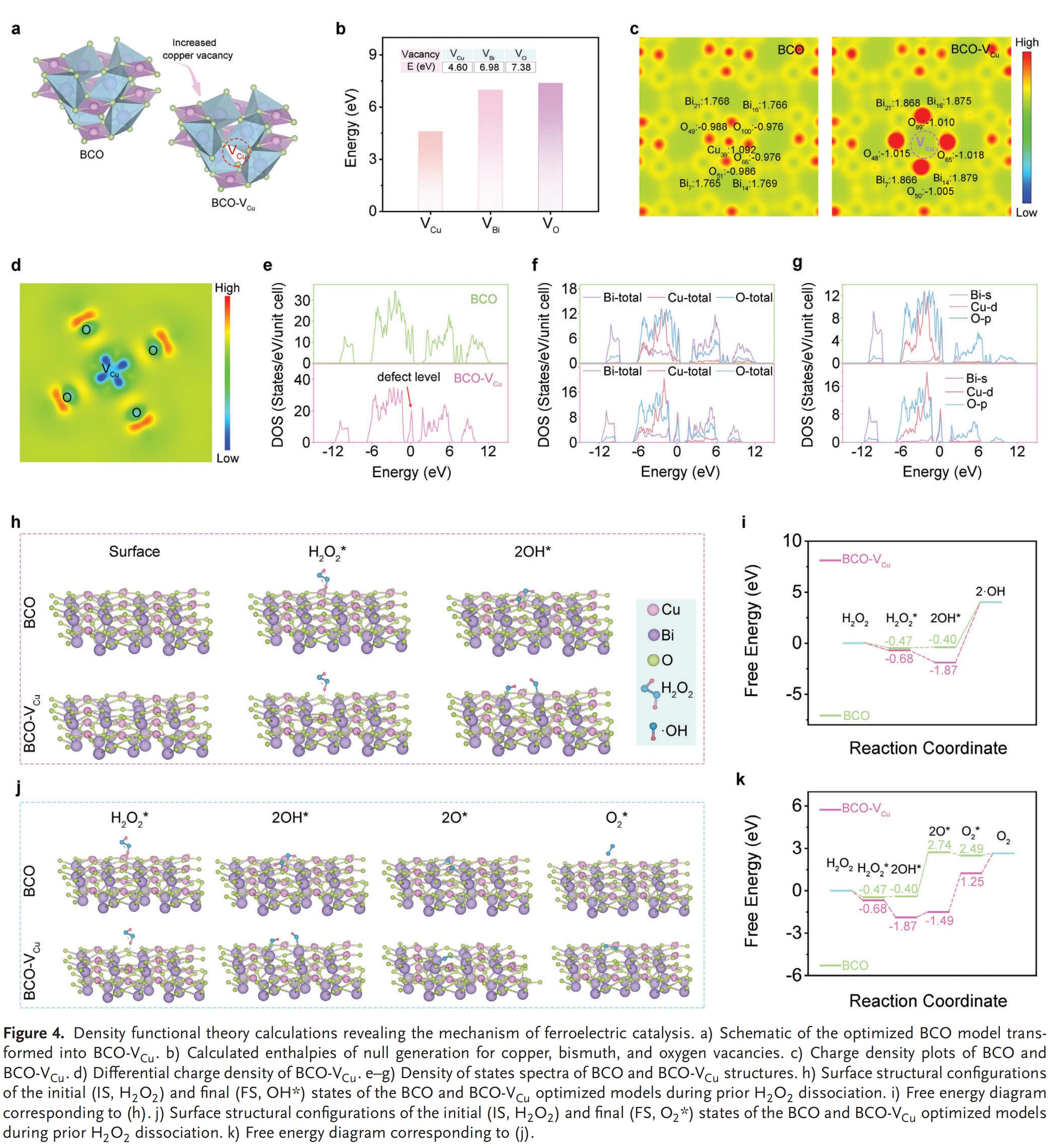
3.DFT计算
VCU是BCO中最易形成的空位缺陷,能引入缺陷能级使BCO-VCU带隙变窄,并通过形成低电子密度区捕获空穴,提升电子-空穴的分离效率。同时,VCU作为活性位点能有效吸附并活化H2O2,降低了·OH生成和O2形成的反应能垒,从而加速了ROS生成与氧气析出过程。
4.体外释放Cu²+的能力
BCO-VCU纳米颗粒在多种生理介质中均表现出良好的分散性与稳定性。其铜离子释放行为具有环境响应性:在中性条件(pH 7.2)下几乎不释放,确保了其在体循环中的结构稳定性;而在弱酸性条件(pH 6.4)下,空位缺陷促进了Bi-Cu-O键的断裂,BCO-VCU会缓慢释放铜离子,且释放量高于无空位的BCO,这为其在肿瘤治疗中的应用提供了重要优势,US处理则通过能量输入进一步加速了这一释放过程。
5.体外凋亡与铜诱导凋亡的评价
BCO-VCU表现出了良好的安全性及生物相容性,能被细胞快速内吞。体外实验表明,BCO-VCU在US激活下,能通过铁电催化效应有效诱导肿瘤细胞发生凋亡和铜死亡,并激发后续的免疫反应。具体来说,在US激活下,其产生的铁电效应一方面通过增强细胞膜通透性,促进Ca²+内流引发钙超载;另一方面催化产生大量ROS,导致线粒体损伤,并通过调节Bax/Bcl-2等蛋白表达诱导细胞凋亡。同时,BCO-VCU还能在细胞内触发铜死亡,即通过释放Cu²+、消耗GSH、产生O2、引起关键蛋白FDX1/LIAS表达下调和DLAT异常寡聚,导致独特的线粒体毒性。细胞凋亡和铜死亡后释放ATP和促炎介质HMGB1,有效诱导ICD,增强DCs活化,激活NF-KB信号通路并导致巨噬细胞M1极化,为激发抗肿瘤免疫应答奠定了基础。

6.体内抗肿瘤作用
BCO-VCU凭借其高原子序数元素铋(Bi)的存在,在体内表现出优异的CT成像能力,在静脉注射后能在肿瘤部位有效富集和长时间滞留.同时,该材料也可作为T1加权磁共振成像(MR)的对比剂,在注射8小时后于肿瘤区域达到信号强度峰值。在治疗方面,通过双侧荷瘤小鼠模型证实,BCO-VCU在US激活下不仅能显著抑制原发性肿瘤和远处转移瘤的增殖,还能通过铁电效应激活系统性抗肿瘤免疫应答,包括促进DCs成熟、增加CD4+和CD8+ T细胞的浸润、诱导巨噬细胞向M1型极化,并降低调节性T细胞(Treg)比例,从而重塑肿瘤免疫微环境。此外,该治疗未引起其他主要器官的明显损伤、炎症反应或血液生化指标异常,显示出良好的生物安全性。

7.治疗分子机制
经BCO-VCU+US处理的小鼠肿瘤组织与对照组的RNA转录分析相比共有775个差异表达基因,其中Cxcl3、Cxcl2和Cd4等免疫相关基因显著上调,而参与谷胱甘肽代谢的Gstm1则下调。这些基因与炎症反应、免疫细胞分化及氧化应激代谢密切相关。进一步的KEGG和GO富集分析表明,经BCO-VCU+US处理后大量免疫相关通路被激活,包括B细胞受体信号、cAMP信号、细胞因子-细胞因子受体相互作用、Th1/Th2细胞分化以及趋化因子信号通路等。这些通路的激活共同促进了DCs成熟、M1巨噬细胞极化和T细胞分化,并通过抑制肿瘤细胞内GSH代谢增强氧化应激损伤,从而推动肿瘤细胞死亡。

这项研究受铁电催化启发,合理设计并工程化了富含VCU的铁电性BCO-VCU纳米颗粒,兼具超高压电、铁电性及优异的铁电催化性能。在US激活下,BCO-VCU能有效引发能带弯曲和电子-空穴分离并产生高催化活性,导致ROS爆发并诱导细胞凋亡;同时,其铁电效应增强了细胞膜通透性,促进了BCO-VCU的内吞,进而改变了铜死亡关键蛋白FDX1和DLAT的表达,此过程还伴随ATP的释放,下调铜离子外排蛋白ATP7A/B的表达,减少Cu+外流,加剧铜死亡。细胞凋亡和铜死亡共同激发了ICD,随之触发了强烈的后续免疫反应,表现为DCs成熟、巨噬细胞极化为M1表型、CD8+ T细胞分化和细胞毒性T淋巴细胞(CTL)数量增加,最终实现了免疫微环境重塑和免疫记忆,强化了免疫治疗效果。

